问题1:
①这种情况以反应器外推,假如10个反应器也是一样需要每个都做一次验证是吧,还是随机选择一定数量的开展即可?②假如一个反应器的3批验证成功,但是在另外在9个反应器中开展的9批验证,中间要是有1-2批失败,重新开展验证后成功,这样是否可以认为工艺验证合格?(有相应的失败原因调查,但不知道是否能被接受)
问题2:

这里的不包括多批次的原液零头合批,是否意味着可以使用1批原液零头或2批原液零头进行合批操作:①假如上一批原液剩余10%,加上这一批原液的全部合批是否可行?②假如上一批原液剩余10%,这一批原液的批量加上80%合批是否可行?(这种情况可能较少,因为这样说明批量的设置不合理)
根据2025.04.07 CFDI发布《工艺验证检查指南》,
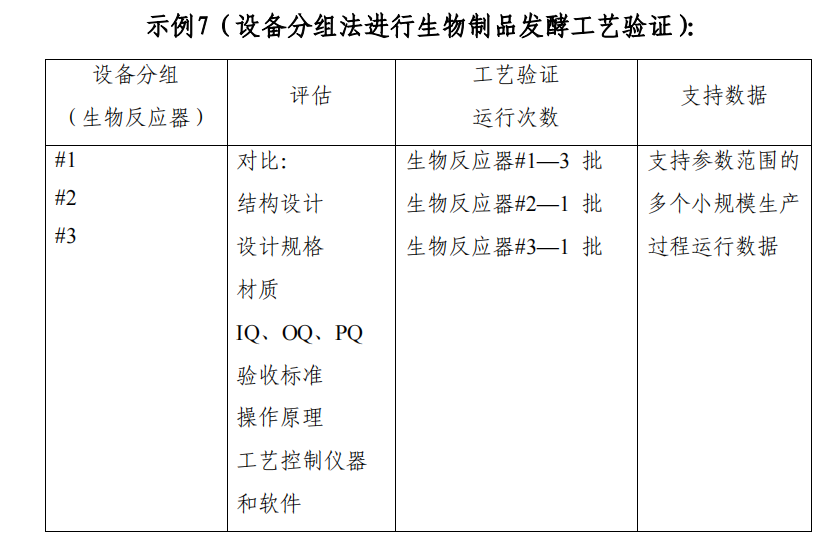
问题1:参考监管发布指南的示例7(设备分组法进行生物制品发酵工艺验证),以反应器外推,假如10个反应器在完成对比评估后也是一样,一般3+1+1+1.....共计12批,对于新引入产品,没有足够的先验知识和数据,一般随机选择一定数量的开展不被接受。如PDA TR.60提及“相同设备行列减少批数需要显示每个的工艺是可靠的。在这种情况下,在工艺性能方面有充足的先前知识。分组法中减少批数应考虑工艺已有知识的量,关键工艺参数的数量和影响,以及控制参数在范围内的能力。对于一个没有关键工艺参数的操作单元,使用较少的批数是适合的。在这些情况下,分组法应在验证方案中经过清晰的论证,论证要有支持数据参考”。
假如一个反应器的3批验证成功,但是在另外在9个反应器中开展的9批验证,中间要是有1-2批失败,重新开展验证后成功,这样是否可以认为工艺验证合格?(有相应的失败原因调查,但不知道是否能被接受)
建议基于根据相应调查失败原因评估,若不属于工艺参数、设备因素(影响设备一致可比性)等导致,重新开展工艺确认/验证后符合预期要求,一般可接受。
问题2:按照指南更新后,该内容描述同样发生更新,强调“验证当包括原液批次数以及每批原液的比例范围”“考虑不同的混合体积比例、批次数目等的变异可能对解冻(如涉及)和配制混匀过程产生的影响”等风险点。
7.3 生物制品的多批原液混合生产制剂的验证
如果存在多批原液混合生产一批制剂的情况,应当首先确保每批次原液的质量符合要求、可追溯,原液混合生产等工艺稳定可控。如单一原液的生物制品采用多批原液混合生产制剂的,至少满足以下要求:
7.3.1 多批原液混合应当经过验证,验证应当包括原液批次数以及每批原液的比例范围。
7.3.2 应当根据混合策略充分评估确定验证方案,需要考虑不同的混合体积比例、批次数目等的变异可能对解冻(如涉及)和配制混匀过程产生的影响。
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
